Léčba nádorů nanočásticemi by mohla být v klinické praxi do deseti let, říká vědkyně z ICRC Soraia Fernandes
Portugalská vědkyně Soraia Fernandes je už přes šest let součástí výzkumné skupiny Mechanobiology of Disease vedené Giancarlo Fortem. Nyní však díky programu MSCA Fellowships Mobility Support na čas změnila své působiště. Získala stáž na University of Melbourne v Austrálii, kde se věnuje výzkumu protinádorových terapií nanočásticemi. Se Soraiou jsme mluvili nejen o její práci, ale i o rozdílech vědeckého prostředí v Evropě a Austrálii a taky o výzvách, které práce vědkyně s sebou nese.

Soraia Fernades analyzuje nádorové tkáně pacientů na ICRC v Brně.
Je to už půl roku, co jste na stáži na University of Melbourne. Čím se tamní prostředí liší od toho, na které jste byla zvyklá v brněnském ICRC?
Několik rozdílů vnímám. V ICRC máme přístup k široké škále přístrojů pro biologickou charakterizaci. Tady na univerzitě má naše skupina vlastní chemické laboratoře a přístup k vynikajícímu zařízení včetně mikroskopů s vysokým rozlišením. Můžeme zároveň využívat zařízení i z jiných kateder a spolupracovat s jinými výzkumnými skupinami. Výzkumné prostředí je však ve své podstatě podobné. Řekla bych ale, že to v Austrálii je o něco víc konkurenční. Přijde mi, že v Evropě máme mnohem více příležitostí k získávání grantů, nepanuje tam tedy taková soutěživost jako tady.
Jaké nejcennější zkušenosti vám stáž doposud dala?
Dala mi možnost osamostatnit se a rozvíjet vlastní nápady. Za projekt, na kterém tu pracuji, nesu plnou odpovědnost a mohu jej tak posouvat dál. Dalším cenným aspektem je samotná příležitost propojení práce v ICRC a University of Melbourne. Můžu tak těžit z poznatků obou pracovišť.
„Řekla bych, že vědecké prostředí v Austrálii je konkurenčnější. V Evropě máme mnohem více grantových příležitostí.“
Váš výzkum se zaměřuje na nanočástice a jejich roli v léčbě nádorů. K čemu by měl váš výzkum v konečném důsledku přispět?
S nanočásticemi, které mají za úkol bojovat proti nádorovému bujení, jsem začala pracovat už během svého doktorského studia. Má práce se tehdy zaměřovala především na solidní nádory (nádory, které vznikají jako masa abnormálně rostoucích buněk ve tkáni nebo orgánu, pozn.). V brněnském ICRC jsem pak měla příležitost podílet se na projektu přímo s lékaři z Fakultní nemocnice u sv. Anny. Díky tomu jsem problematice porozuměla o poznání hlouběji, zejména co se týče vývoje, růstu a prognózy nádorových onemocnění. A dnes už vím, že některé vlastnosti nádoru mohou léčebnou účinnost nanočástic ovlivnit. Třeba nadměrný extracelulární matrix, tedy mimobuněčná hmota, která se nachází mezi buňkami tkání. V místě nádoru může tedy fungovat jako fyzická bariéra, která brání pronikání léčiva. Chci studovat, jak nanočástice s různými složkami nádorového mikroprostředí interagují. Projekt, na kterém teď pracuji, by měl identifikovat vlastnosti nanočástic, které umožní lepší průnik, a tím pádem účinnější distribuci léčiva. Věnuji se léčbě zaměřené přímo na extracelulární matrix a jeho hlavní producenty – fibroblasty.
![]()
![]()
3D vyobrazení nádoru (růžová barva) napadající zdravý plicní organoid (zelená barva) Vzorek nádoru byl získaný od pacienta, snímek pořízen konfokálním mikroskopem v ICRC.
Můžete popsat mechanismus, jakým způsobem se nanočástice chovají uvnitř těla, jak konkrétně fungují? Jsou pozorovány při léčbě nanočásticemi nějaké vedlejší účinky?
Různé typy nanočástic mají různé mechanismy. Na University of Melbourne pracuji se dvěma typy, ten první se nazývá glykogenové, to jsou přírodní nanočástice, které jsou poměrně biokompatibilní. To znamená, že obvykle nejsou pro buňky toxické. S týmem profesora Franka Carusa zaměřujeme na tzv. metal-phenolic network nanoparticles (volně přeloženo jako metal-fenolové síťové nanočástice). Oba typy můžou být použity jako nosiče chemoterapeutického léčiva. Dnes už je možné jimi distribuovat také různé typy nukleových kyselin a využít je tak pro RNA terapie. Po zapouzdření molekul těchto látek se nanočástice použijí k transportu přímo na místo nádoru. To provádíme změnou povrchových vlastností, aby nanočástice měly k určitým buňkám větší přitažlivost než k jiným. Případně jde také k nanočásticím připojit určité protilátky, které samy rozpoznají určitý typ buněk. Pokud to shrnu – nanočástice jsou malé nosiče účinných látek, které umí dopravit na potřebné místo, tedy do nádoru.
„Projekt, na kterém teď pracuji, by měl identifikovat vlastnosti nanočástic, které umožní lepší průnik, a tím pádem účinnější distribuci léčiva ke konkrétnímu nádoru.“
Nanočástice tedy slouží jako doplněk klasické chemoterapie nebo radioterapie, díky čemuž je pak léčba účinnější. Pokud dopravují léčivo cíleně, znamená to, že méně zasahuje okolní buňky a terapie nanočásticemi tak sníží negativní dopad jinak agresivní léčby na tělo pacienta?
Ano, chemoterapie způsobuje tolik nežádoucích účinků, jako třeba vypadávání vlasů, nevolnosti a zvracení právě proto, že ovlivňuje všechny buňky v těle. Je to systémová léčba, není cílená, pacienti se během chemoterapie cítí opravdu špatně. Při práci s nanočásticemi se snažíme léčbu zaměřit na tu tkáň, která ji potřebuje, čímž eliminujeme, nebo aspoň zmírňujeme spoustu vedlejších účinků. Jakmile budou tyto léčebné systémy optimalizovány, mohly by nahradit současnou chemoterapii.
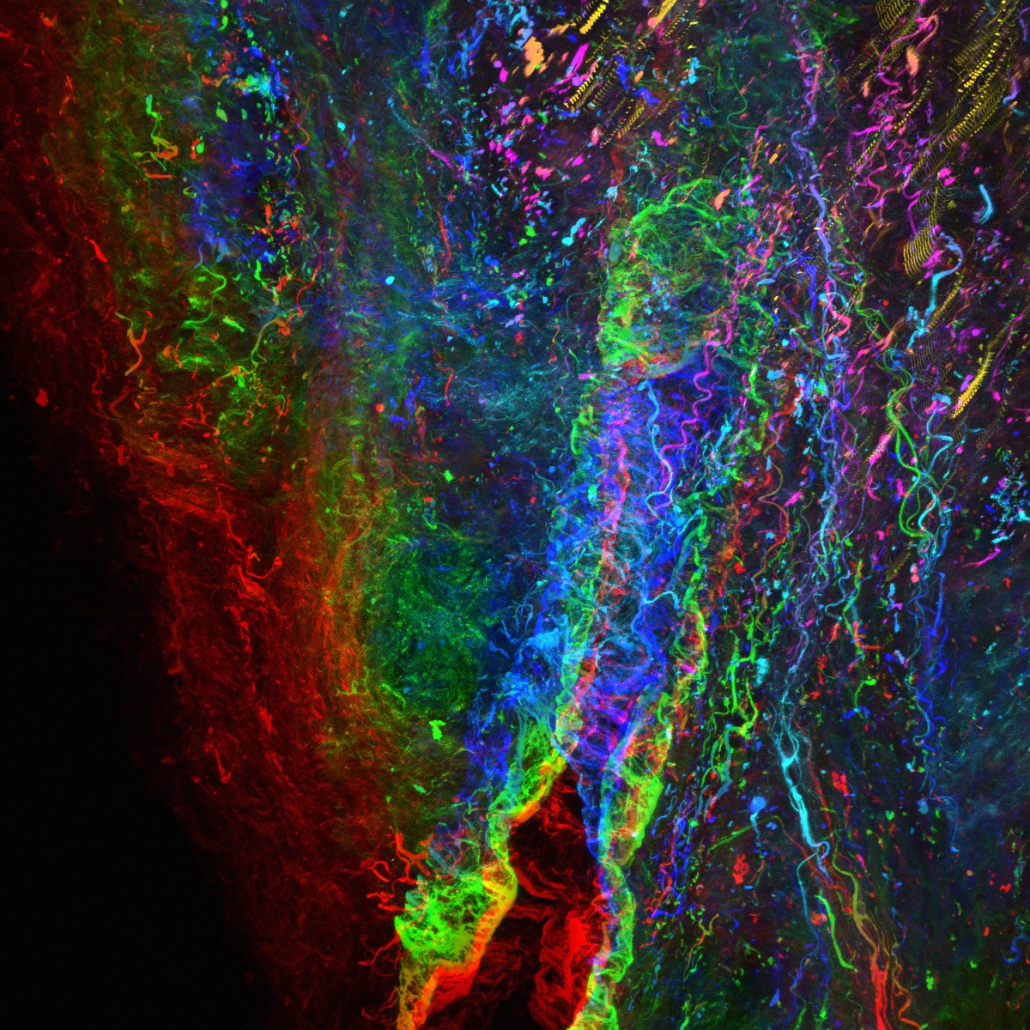
Vzorek extracelulárního matrixu získaného od pacienta zobrazující zdravá kolagenová vlákna. Snímek pořízený dvoufotonovým mikroskopem na ICRC.
Jakou metodou účinnost léčby nanočásticemi ověřujete?
Nejjednodušeji se nanočástice pozorují pomocí fluorescenčního značení. Pokud zbarvíme jejich povrch nebo vnitřek, můžeme sledovat jejich pohyb uvnitř buněk nebo uvnitř tkání laboratorních myší.
Jak dlouho bude podle vás trvat, než se tato léčba dostane do běžné lékařské praxe?
Odhaduji, že během deseti let, možná i míň. Soudím podle toho, že podobné postupy se používají už nyní. Třeba lék Doxil. Léčivo doxorubicin se podá pacientovi ve speciálním typu nanočástice – liposomu. Může být použitý jako samostatná léčba nebo v kombinaci s jinými metodami. Na nanočásticích jsou založené také novější vakcíny proti COVID-19 od Pfizeru nebo Moderny. Nemyslím si tedy, že to bude trvat dlouho, a věřím, že to bude účinnější než současné možnosti léčby.
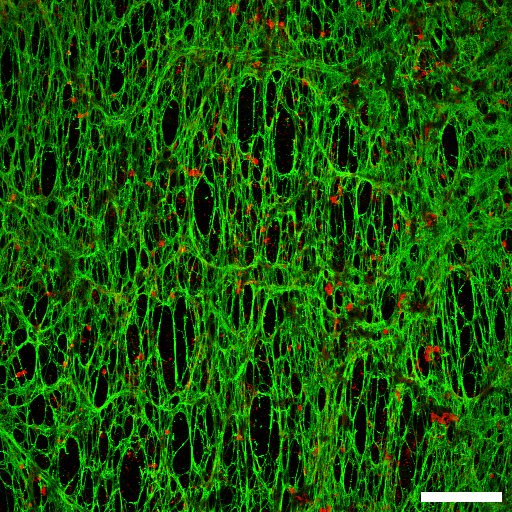
Interakce nanočástic (zobrazeny červeně) s extracelulárním matrixem (zobrazen zeleně) produkovaným fibroblasty spojenými s nádorem. Snímek byl pořízený konfokálním mikroskopem na University of Melbourne.
Věnujete se ve svém výzkumu určitému typu rakoviny nebo zkoumáte nádory obecně?
Tady na stáži na University of Melbourne se nezaměřujeme jen na rakovinu. Zkoumáme třeba i distribuci inzulínu při cukrovce. Já osobně jsem pracovala především s nádory tlustého střeva, prsu a na ICRC jsem se věnovala nádorům prostaty. V Brně jsme vytvořili organoidní model, na kterém jsme studovali vývoj onemocnění a intenzivně jsme spolupracovali s klinickými lékaři.
Čeho byste ráda dosáhla během své australské stáže? Máte konkrétní cíl?
Co se týče vědecké práce, chci popsat, jak nanočástice interagují s mikroprostředím nádoru a popsat konkrétní vlastnosti, které by měly mít, aby se nezdržovaly ve fibrózním extracelulárním matrixu a mohly efektivně proniknout do nádoru a ničit tak rakovinné buňky. Případně zjistit, jakým způsobem modulovat extracelulární matrix. Tady v Melbourne mám k dispozici materiálovou expertizu a v Brně organoidní modely a pacientské tkáně, můžu to tak testovat přímo na nich, to je obrovský krok kupředu.
„Léčba nanočásticemi se zaměřuje na konkrétní tkáň, což zmírňuje spoustu nežádoucích účinků, jako třeba vypadávání vlasů, nevolnosti a zvracení.“
Proč jste se začala věnovat právě této oblasti?
Myslím, že hlavním důvodem, proč se většina vědců rozhodne pro výzkum v této oblasti je ten, že rakovina je náročná nemoc, pro kterou stále nemáme jednoduché řešení. Tím spíš, když se v těle šíří metastáze. Ta zátěž pro pacienta je obrovská a výsledek léčby často nejistý. Bohužel si touto zkušeností prošla i má rodina. Myslím, že většina lidí má ve svém okolí někoho, kdo s nádorem bojuje nebo v minulosti bojoval. Mou motivací je tedy pomoci najít lepší způsoby léčby než ty, které máme momentálně k dispozici, nebo aspoň pochopit, proč a co nefunguje, a připravit budoucím vědcům cestu k lepšímu řešení.
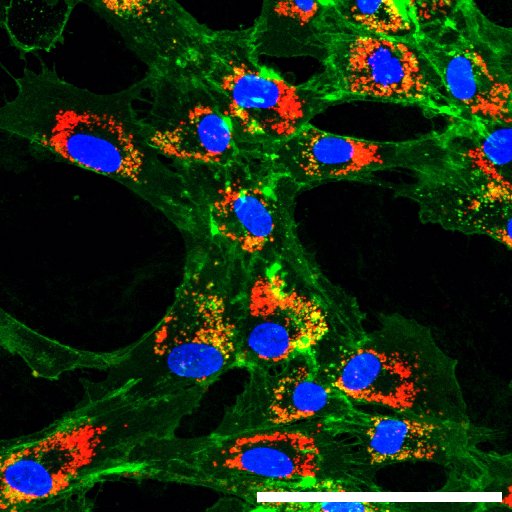
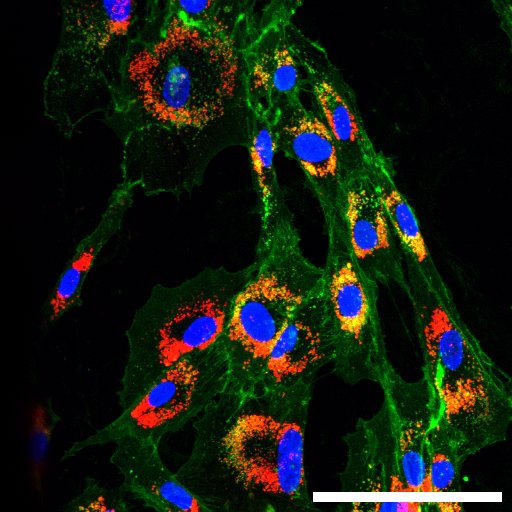
Internalizace (proces, při kterém buňka pohlcuje nebo vstřebává něco z okolí dovnitř sebe) nanočástic (červená barva) fibroblasty spojenými s nádorem. Jádra buněk jsou zobrazená modře, buněčná membrána zeleně. Snímky byly pořízené konfokálním mikroskopem na University of Melbourne.
Co je podle vás nejnáročnějším aspektem práce ve vědě?
Myslím, že v mém oboru je nejnáročnější navazování spoluprací s klinickými lékaři. Nejsou vždy otevření diskuzi nebo spolupráci s vědci na naší úrovni. V Brně to fungovalo skvěle, měli jsme Fakultní nemocnici u sv. Anny, lékaři tam vycházeli vstříc novým nápadům, co se týče navazování spoluprací, měli jsme dveře otevřené. Takové propojení je však poměrně vzácné. Nejtěžší je tedy překlenout tu propast a navázat užší spolupráci s nemocnicemi a klinikami, které poskytují potřebné terapie.
„Taková spolupráce mezi vědci a lékaři jako ta, která vzniká v rámci ICRC a FNUSA, je vzácná.“
A pro vás osobně?
Já jsem spokojená, mám svou práci ráda. V práci často zůstáváme dlouho, na druhou stranu máme určitou flexibilitu. Možnost spolupracovat s lidmi z celého světa a navazovat kontakty s různými institucemi a odborníky, vyměňovat si poznatky a čerpat z jejich znalostí je úžasné. To, že jde však o poměrně nestabilní práci a rovnováha mezi soukromým a pracovním životem se udržuje poměrně hůře, může být pro někoho problematické. Práce ve vědě také vyžaduje časté stěhování a změnu působiště, a to i mezinárodně. Pro mě osobně to ale problém nepředstavuje, za překážku to nepovažuji. Aspoň zatím.
Daří se vám udržet balanc mezi náročnou a intenzivní prací a osobním životem?
Zatím ano. Je náročné být daleko od rodiny, ale to asi pociťuje každý, kdo pracuje v zahraničí. Nevím, jestli bych to nazývala problémem, když si život v cizině vybere člověk sám. Neznamená to, že to tak bude navždy, ale momentálně se mi daří udržovat rovnováhu v životě velmi dobře.
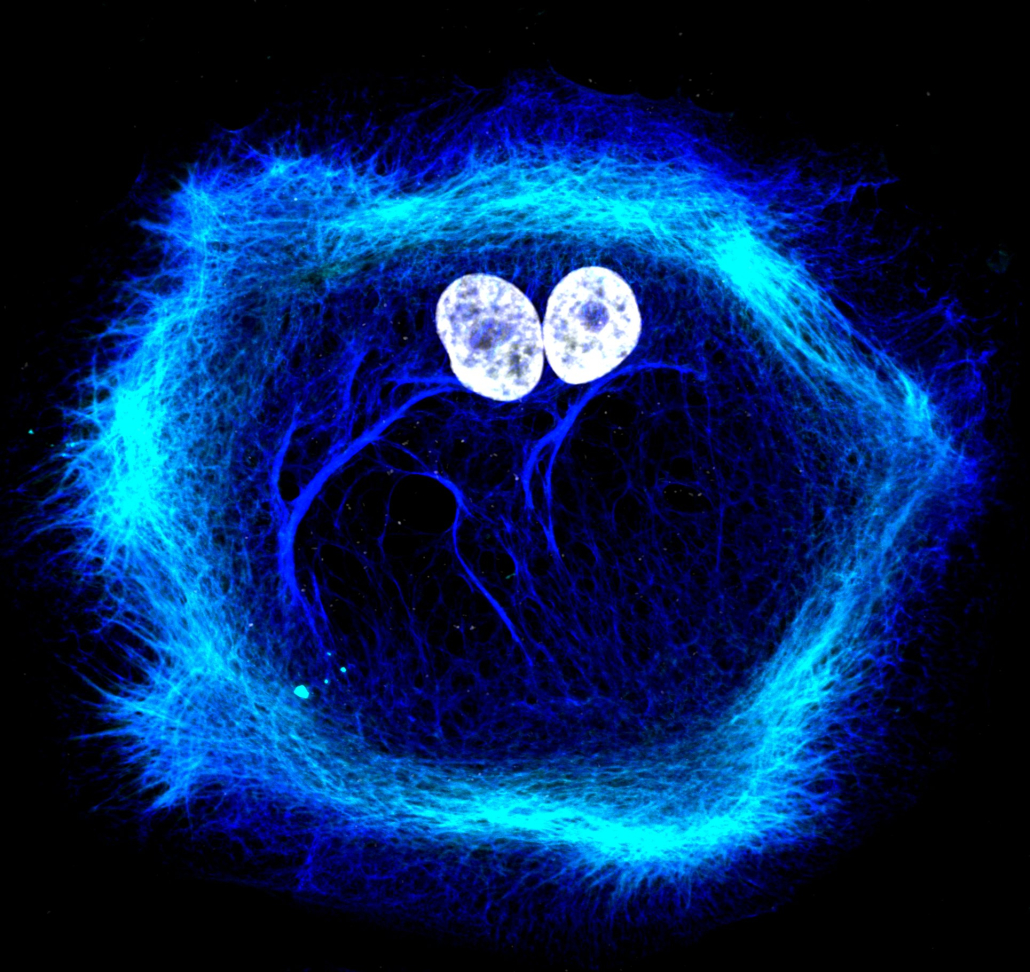
Buňky rakoviny prostaty. Jádra buněk jsou zobrazeny bíle, cytoskelet modře. Snímek byl pořízen konfokální mikroskopií v ICRC.
Martina Kopecká
martina.kopecka@fnusa.cz

Pobyt a následná návratová fáze jsou financovány Evropskou unií prostřednictvím Operačního programu Jan Amos Komenský (OP JAK), projekt „Podpora mobilit MSCA Fellowships ve FNUSA-ICRC“ s reg. č. CZ.02.01.01/00/22_010/0008814.






